| Cuando las células ciliadas están muriendo, las células de sostén reciben señales que las alientan a iniciar el proceso de regeneración. Estas señales implican cambios en la actividad de ciertas proteínas que actúan en conjunto para determinar el destino exacto de cada célula de sostén. Se ha encontrado que muchas de estas proteínas se encuentran activas durante el desarrollo del oído interno. Durante la regeneración, estas señales pueden ser activadas en cuestión de horas luego de que las células ciliadas hayan sido dañadas, lo cual resulta en la restauración de las células ciliadas a niveles casi normales, sólo 4 semanas más tarde.
|
| Varias proteínas presentes en las células de sostén pueden favorecer o desfavorecer la capacidad de una célula de sostén,de diferenciarse en una célula ciliada, luego de daños producidos en el epitelio sensorial. Durante el desarrollo embrionario, se ha encontrado que el factor de transcripción compuesto por el motivo básico hélice-lazo-hélice, llamado atonal homolog 1 o Atoh1, es tanto necesario como suficiente para la diferenciación de la célula ciliada del oído interno de los mamíferos. Debido a su rol crucial en el desarrollo de las células ciliadas, Atoh1 se ha convertido en un candidato primordial para estimular la regeneración de las células ciliadas. En la década pasada, varios laboratorios han empleado técnicas que estimulan la expresión de Atoh1 en células de sostén, obteniendo resultados mixtos. Durante el desarrollo post-natal temprano, la sobre-expresión de Atoh1 promueve la conversión de células de sostén en células ciliadas, mientras que en los mamíferos maduros, los efectos de Atoh1 parecen ser más limitados. Mientras que Atoh1 promueve la conversión en células ciliadas, algunas proteínas en la vía de señalización notch actúan para bloquear la regeneración de las células ciliadas. La señalización a través del receptor notch es responsable de un proceso llamado inhibición lateral, que se encuentra activo durante el desarrollo del epitelio auditivo y que asegura que al final de este proceso, se llegue al número y patrón de generación correctos de células ciliadas y de sostén. Notch realiza esta tarea por medio de una serie de interacciones moleculares, que incluyen la activación de factores de transcripción que inhiben la expresión de Atoh1. Los receptores Notch se expresan en la superficie de las células de sostén durante el desarrollo, y las proteínas que se unen a notch, se expresan asimismo en la superficie de las células ciliadas en desarrollo. Cuando el receptor notch se une a proteínas específicas (proteínas DSL como Delta), una parte del receptor notch (el dominio intracelular o NICD) es cortado por una enzima llamada gamma secretasa, y el NICD transloca entonces al núcleo. Una vez en el núcleo, el NICD puede activar factores de transcripción inhibitorios e impedir la expresión de Atoh1 en la célula de sostén, evitando que ésta se diferencie a una célula ciliada. La inhibición de la señalización via notch luego de un daño a las células ciliadas en animales maduros, lleva a un aumento en el número de células de sostén que se transdiferencian a células ciliadas, en peces, aves y mamíferos.
Por lo tanto, los inhibidores de notch resultan agentes potencialmente interesantes en la investigación, en virtud de su capacidad para promover la regeneración de células ciliadas y el re-establecimiento de la función auditiva en mamíferos. Además de Atoh1 y la vía de señalización notch, probablemente existen muchas otras proteínas que controlan la regeneración de las células ciliadas y que aún no han sido identificadas.
Para comprender cómo las señales notch actúan para incrementar los niveles de Atoh1, puede ser útil revisar esta vía de señalización. S. Blatrix, after B. Lewis
|
| Aquí, podemos ver tres células de sostén en rosa y dos células ciliadas en azul. Cuando algunas células ciliadas son dañadas o mueren, la expresión de Delta aumenta en algunas células de sostén. Las células de sostén con niveles altos de Delta, inhiben a otras células de sostén vecinas e impiden que se conviertan en células ciliadas, ya que Delta se une al receptor de notch en esas células e inhibe la expresión de Atoh1. Cuando Delta se une al receptor notch en una célula adyacente, el receptor es cortado por una gamma secretasa, liberando el dominio intracelular de la membrana plasmática y permitiendo que el mismo viaje al núcleo. Una vez translocado al núcleo, NICD estimula factores de transcripción inhibitorios que bloquean la expresión de Atoh1. Debido a este proceso, llamado inhibición lateral, la expresión de Atoh1 es bloqueada en algunas células de sostén mientras que las células vecinas acumulan la proteína Atoh1 y se diferencian en células ciliadas.
|
|
Regeneración en mamíferos.
|
| La esperanza en las terapias regenerativas nació en los 1980’s cuando se descubrió que el oído interno de las aves podía regenerar células ciliadas que habían sido dañadas previamente mediante el empleo de drogas o de un trauma acústico, y hacer que éstas incluso pudieran reconectarse al cerebro. Muchos grupos de investigación en todo el mundo han intentado desde entonces reproducir esta regeneración en la cóclea de mamíferos. Hasta ahora no ha habido suerte: las celulas ciliadas de mamíferos no pueden regenerarse!!!
La investigación continúa en dos direcciones.
Una intenta 'despertar' algunas células de sostén que se encuentran en la cóclea del adulto. La restante busca implantar células madre embrionarias en la cóclea, y luego ayudar a diferenciarlas en células ciliadas para que puedan tomar el lugar vacante dejado por aquellas que se perdieron. S. Blatrix, d'après J. Stone En ambas estrategias, necesitaríamos de todas formas re-establecer la conexión de estas células ciliadas con el cerebro. El desafío es grande, y no podemos en esta instancia, predecir si estos métodos funcionarán ni tampoco dar una fecha indicativa sobre su uso potencial en la terapéutica.
|
Restauración del equilibrio
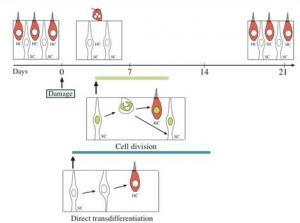
Cuando las células ciliadas se pierden en el sistema vestibular en animales que no son mamíferos, pueden regenerarse con facilidad. En aves, las nuevas células ciliadas son eficaces en la restauración del equilibrio. Los órganos vestibulares, a diferencia de los auditivos, albergan en sus células ciliadas la capacidad de regenerarse continuamente (muerte y regeneración), incluso en ausencia de daño a las células ciliadas. Muchos estudios han mostrado que los mamíferos maduros (roedores) también pueden regenerar algunas de sus células ciliadas vestibulares luego de un daño causado a éstas. En roedores recién nacidos, las células ciliadas pueden ser fácilmente reemplazadas por división celular y también posiblemente por transdiferenciación. Sin embargo, cuando los roedores maduran y entran en la adultez, el número de células de sostén que se divide, se ve reducido drásticamente. Sólo una subpoblación de células ciliadas es reemplazada aparentemente por transdiferenciación directa. La presencia de cierta capacidad de regeneración de células ciliadas en respuesta a la pérdida de células ciliadas en mamíferos, ha dado a los científicos la oportunidad de estudiar la regeneración en mamíferos y encontrar formas experimentales de favorecerla.
|
|
 Français
Français
 English
English
 Español
Español
 Português
Português

Facebook Twitter Google+