CCE: Fisiología
Diseño: Guy Rebillard, Rémy Pujol
CCE es la electro-motilidad: responden a la transducción mecano-eléctrica (en forma similar a las CCI) a través de un mecanismo de transducción inversa (electro-mecánica). Se trata de un mecanismo activo de amplificación que confiere a la cóclea gran sensibilidad y selectividad de frecuencias.
El amplificador coclear
A comienzos de los años 80, la comprensión de la fisiología coclear se enfrentaba a una contadicción : por un lado, los neurofisiólogos describían una selectividad de frecuencias considerable al nivel de las fibras del nervio auditivo, y por otro lado, la teoría de la onda propagada de Békésy sólo permitía imaginar la cóclea como un filtro pasivo incapaz de dar cuenta de esta selectividad. Sin embargo, ya en 1948, un médico, Gold, había hablado de la existencia de ¨procesos mecánicos activos ¨!
Dos tipos de resultados debilitaron la noción de coclea ¨pasiva¨ : el descubrimiento de las emisiones oto-acústicas y las mediciones precisas de la vibración del órgano de Corti (membrana basilar) en respuesta a un sonido puro, mostraron que la concordancia en frecuencias se establecía antes de la llegada del mensaje nervioso al nervio auditivo.
El doble mecanismo de transducción
Como en el caso de las CCI, las vibraciones acústicas producen el movimiento de los estereocilios de las CCE, que se traduce en una modulación del potencial de estas células. De esta manera, en el caso de un sonido puro, los estereocilios oscilarán de forma sinusoidal, lo que va a inducir una sucesión de ciclos de despolarización y repolarización de las CCE. Esta actividad eléctrica puede medirse experimentalmente y se llama potencial microfónico. Al contrario que lo ocurrido en las CCI, las variaciones de potencial provocan un cambio de la forma de las CCE. Cuando son despolarizadas se acortan, mientras que se alargan durante la fase de repolarización. La modificación de la longitud de las CCE se debe al cambio de conformación de una proteína muy abundante en su membrana celular, la prestina, bajo los efectos de los cambios de potencial. Las CCE actúan como osciladores que amplifican muy localmente la vibración de la membrana basilar. Esta propiedad de las CCE aumenta la sensibilidad de la cóclea en aproximadamente unos 60dB y mejora la capacidad de codificar en forma diferente, frecuencias muy próximas entre sí. El rol desempeñado por las CCE resulta por lo tanto primordial para la función auditiva.
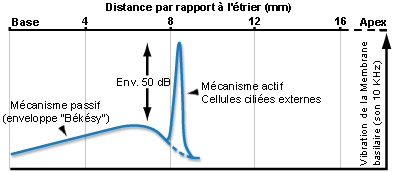
Para un sonido de frecuencia pura, el mecanismo activo amplifica (aproximadamente unos 50dB) la vibración de la membrana basilar (lo que aumenta la sensibilidad de la cóclea) en una porción muy estrecha del órgano de Corti. Dos frecuencias muy próximas entre sí pueden, de esta manera, activar dos regiones diferentes de la cóclea permitiendo asi la discriminación entre una y otra (selectividad de frecuencias). Esta concordancia de frecuencias (tuning) depende íntimamente de las propiedades de electromotilidad de las CCE y se encuentra asimismo al nivel de las fibras del nervio auditivo, al cual es transmitida fielmente por las CCI.
Electromotilidad
La electromotilidad fue descubierta en 1983 en una preparación de células ciliadas externas (CCE) disociadas. A partir de ese momento, esta propiedad contráctil propia de las CCE ha sido estudiada en detalle. Se trata de un mecanismo rápido (con la capacidad de seguir frecuencias elevadas de hasta unos 20 kHz), y no depende de Ca2+ ni de ATP ; por lo tanto no consume directamente energía (aún cuando la fisiología general de las CCE necesita evidentemente de una fuente de energía dependiente de ATP). La contracción de las CCE es el resultado de la suma de las contracciones individuales de los elementos ¨motores¨ localizados en la membrana lateral de las CCE. Se considera actualmente que la despolarización de las CCE (entrada de K+ al comienzo de la estimulación sonora) modifica la conformación de una proteína transmembrana, la PRESTINA, que desempeña de esta manera el rol de elemento motor (ver animación más abajo). Este concepto ha sido recientemente confirmado, más allá de toda duda, a través del clonado del gen de la prestina y su ablación, anulando la electromotilidad.
Animación de S. Blatrix concebida por G. Rebillard
La despolarización de las CCE produce la traslocación de aniones, probablemente Cl–, fuera de sus sitios de unión a la prestina y hacia el interior del citoplasma. Este desplazamiento de cargas induce un acortamiento de la proteína que se traduce en un acortamiento de la CCE.
Lo opuesto ocurre cuando la CCE se repolariza, en este caso los aniones se unen a la prestina y provocan una elongación de la CCE.
Además de la electromotilidad, las CCE aisladas han revelado otras propiedades contráctiles : citemos, por ejemplo, la contracción lenta dependiente de Ca2+ que modula la electromovilidad y que entra en juego in vivo a través de la acción del sistema eferente medio. Actualmente, las propiedades fisiológicas de esta modulación eferente de las CCE no son del todo claras : ¿se trata de un sistema de protección ? ¿de un sistema de atenuación del mecanismo activo implicado en el ¨efecto cocktail¨ ?
Membrana lateral y complejo sub-membrana de una CCE
Las propiedades electromóviles de las CCE se correlacionan con la estructura singular de su membrana lateral (porción de la membrana que abarca desde la placa cuticular hasta el nivel que contiene el núcleo celular) y de un complejo de organelos sub-membranales asociados.
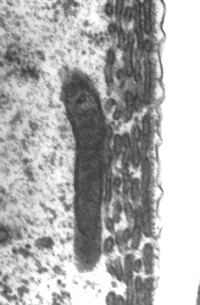
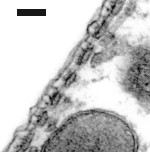
Las cisternas del retículo endoplásmico se alinean entre la membrana plasmática y las mitocondrias. El número de estas estructuras varía desde la base (1 única fila de cisternas: imagen de la derecha) hasta el ápex de la cóclea (4 a 5 : imagen de la izquierda).
Entre la primera (o única) fila de cisternas y la membrana plasmática, podemos distinguir los pilares y otras micro-estructuras que componen el complejo citoesquelético sub-membranal (ver esquema abajo).
Imagenes TEM : R. Pujol y M. Lenoir. Escala : 100 nm.
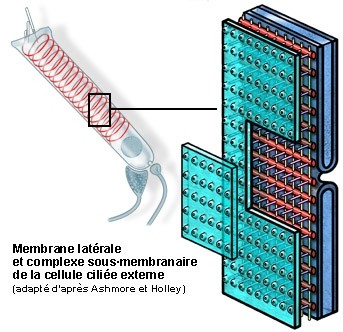
S. Blatrix, adapté d’Ashmore et Holley
Disposición esquemática de la membrana plasmática lateral de una CCE y del citoesqueleto sub-membranal.
Las tres componentes del complejo sub-membranal se distinguen claramente entre la membrana (verde) y la primera cisterna reticular (azul) :
- los filamentos de actina (rojo) que abrazan las CCE, probablemente bajo la forma de un resorte helicoidal (ver esquema de la célula entera) a intervalos de 100nm, aproximadamente.
- los filamentos de espectrina (o fimbrina, en amarillo) dispuestos longitudinalmente a intervalos de 50 nm aproximadamente.
- los pilares (violeta) perpendiculares a la membrana.
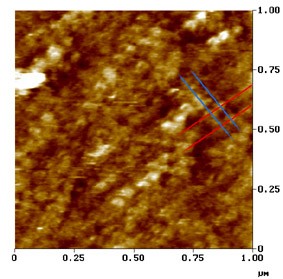
Le Grimellec, Lenoir, Pujol et al.
Imagen en microscopía de campo cercano (fuerza atómica).
Superficie externa de la membrana lateral de una CCE.
En este µm² se distingue una disposición singular de las proteínas de membrana : los trazos oblicuos indican la dirección en la que las proteínas se encuentran alineadas, a intervalos de aprox. 50 nm (trazos en azul) y de 100 nm (trazos en rojo) : ver esquema.
Estas proteínas, que parecen representar la porción trans-membranal de los pilares y podrían ser los ¨motores¨ de las CCE, presentan una forma cónica y, a menudo, un poro central visible.