Fluides cochléaires
Conception : Benjamin Delprat
Les canaux de la cochlée contiennent deux types de fluides : périlymphe et endolymphe. La périlymphe, de composition ionique similaire aux liquides extra-cellulaires, emplit les rampes tympaniques et vestibulaires. L’endolymphe, qui emplit le canal cochléaire, a une composition unique dans l’organisme.
Composition des fluides cochléaires
Une particularité remarquable de la cochlée réside dans la composition unique de l’endolymphe. En effet, ce liquide qui remplit la rampe médiane, est très riche en potassium (150 mM), très pauvre en sodium (1mM) et quasiment dénué de calcium (20 à 30 µM).
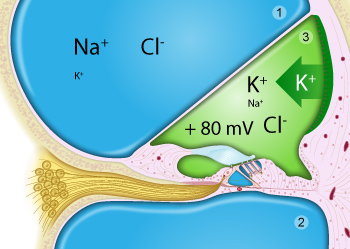
La périlymphe (en bleu) remplit les rampes vestibulaire (1) et tympanique (2).
L’endolymphe (en vert) est le liquide de la rampe médiane ou canal cochléaire (3), très riche en potassium sécrété par la strie vasculaire et qui possède un potentiel positif de +80mV par rapport à la périlymphe.
Notez que seule la surface de l’organe de Corti (notamment les stéréocils des cellules sensorielles) baigne dans l’endolymphe.
Périlymphe
Il existe deux types de périlymphe : la périlymphe de la rampe vestibulaire et celle de la rampe tympanique ; les deux ont une composition est très proche de celle du liquide céphalo-rachidien : riche en sodium (140 mM) et pauvre en potassium (5mM) et calcium (1,2 mM). L’origine de la périlymphe de la rampe vestibulaire diffère de celle de la rampe tympanique. Alors que la périlymphe de la rampe vestibulaire provient du plasma à travers une barrière hémato-périlymphatique, la périlymphe de la rampe tympanique provient du liquide céphalo-rachidien.
Endolymphe
L’endolymphe elle, est générée à partir de la périlymphe.
Le potentiel endocochléaire est la somme de deux potentiels : un potentiel positif du à une sécrétion active de K+ par la strie vasculaire (120 mV), un potentiel négatif du à la diffusion passive des ions K+ des cellules ciliées (40 mV) que l’on peut mettre en évidence suite à une anoxie.
Notons que le développement de la composition ionique de l’endolymphe est précoce par rapport au développement du potentiel endocochléaire. En effet, les concentrations définitives des ions de l’endolymphe se mettent en place pendant la première semaine postnatale chez la souris. En revanche, le potentiel endocochléaire, lui, ne se développe qu’à partir de la deuxième semaine postnatale chez la souris pour arriver à sa valeur finale vers la troisième semaine postnatale.
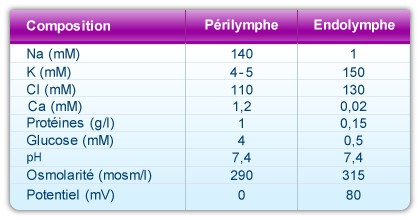
Composition et propriétés des deux fluides cochléaires
Pourquoi l’endolymphe ?
Il semble que la cochlée ait trouvé ainsi le moyen de faire entrer et sortir le potassium sans dépense d’ATP.
En règle générale, si un ion rentre dans une cellule de manière passive, il sortira de manière active et vice versa.
Seul le pôle apical des cellules ciliées baigne dans l’endolymphe très riche en K+ et qui présente un potentiel positif de 80 mV. Les ions K+ vont donc entrer de manière passive puisqu’il y a davantage de potassium dans l’endolymphe que dans la cellule ciliée, et que le potentiel de repos des cellules ciliées est de – 60 mV, ce qui favorise l’entrée de K+. La sortie de ces ions K+ se fera de manière également passive puisque la concentration des ions potassiques est plus grande à l’intérieur de la cellule ciliée qu’à l’extérieur de son corps cellulaire qui baigne dans la périlymphe. Tout ceci résulte dans une économie importante d’ATP par les cellules ciliées.
La strie vasculaire
La structure cochléaire qui génère l’endolymphe s’appelle la strie vasculaire. Cette strie vasculaire est une structure épithéliale complexe composée de plusieurs types cellulaires. Les cellules basales et marginales sont de véritables cellules épithéliales, alors que les cellules intermédiaires sont des ‘melanocytes-like’. Enfin, des vaisseaux sanguins permettent l’apport important en oxygène et nutriments nécessaire au bon fonctionnement de l’ensemble des cellules de la strie vasculaire.
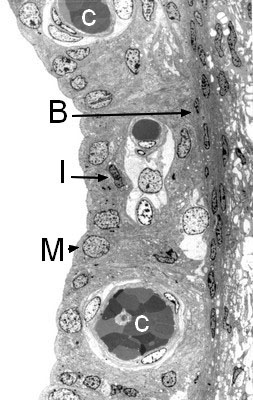
Structure de la strie vasculaire (microscopie électronique à transmission)
Richement vascularisée (C), la strie vasculaire est constituée de trois types cellulaires :
- les cellules marginales (M), qui bordent le canal endolymphatique et jouent un rôle capital dans les échanges ioniques,
- les cellules intermédiaires (I), riches en pigments mélaniques,
- les cellules basales (B).
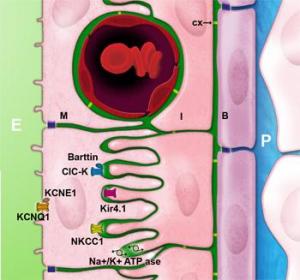
Cycle du potassium
Le flux de potassium provenant des fibrocytes du ligament spiral pénètrent les cellules basales par un réseau de jonctions communicantes. Ces jonctions sont composées de connexons, hexamère 6 protéines transmembranaires appelées connexines ménageant entre elles un canal hydophyle de 2 nm de diamètre. Les connexines 26 et 30 (CX) sont les connexines les plus exprimées dans le mur latéral de la cochlée et dans la strie vasculaire. Des mutations de ces deux gènes sont les causes les plus fréquentes des surdités non syndromiques prélinguales chez l’Homme.
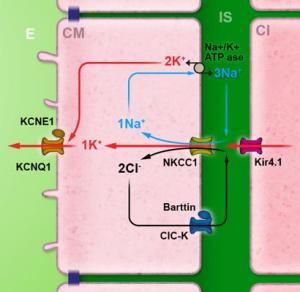
Le potassium passe des cellules basales aux cellules intermédiaires (I) par ce même réseau. Le potassium va sortir des cellules intermédiaires par le canal potassique Kir4.1 pour rejoindre l’espace intrastrial (vert). C’est le passage des ions K+ au travers de la membrane des cellules intermédiaires qui va générer le potentiel endocochléaire. Des mutations de Kir4.1 sont responsables chez l’Homme du syndrome d’EAST (Epilepsie, Ataxie, Surdité et tubulopathie).
Le maintien d’une très faible concentration de potassium (1 mM environ) dans l’espace intrastrial est nécessaire pour générer un potentiel de 100 mV.
Cette tache est effectuée par la Na,K-ATPase exprimée dans la membrane des cellules intermédiaires et des cellules marginales. De plus, le co-transporteur NKCC1, exprimé dans la membrane des cellules marginales, intervient lui aussi dans cette régulation en utilisant le gradient de sodium générer par la Na,K-ATPase pour faire rentrer du potassium dans la cellule marginale.Ce mécanisme d’entrée des ions potassiques dans les cellules marginales est très productif car l’utilisation d’une seule molécule d’ATP est capable de faire rentrer 5 molécules de potassium (2 grâce à la Na,K-ATPase et 3 grâce au co-transporteur NKCC1). Enfin, les ions chlorures, entrés en même temps que les ions sodiques et potassiques, via le co-transporteur NKCC1, sont expulsés par les canaux chlorures ClC-K associés à leur sous unité régulatrice, la barttine.
Des mutations de la barttine sont responsables du syndrome de Bartter, associant une tubulopathie et une surdité. Le potassium va finalement être sécrété dans la rampe médiane par les canaux potassiques KCNQ1 associés à leur sous unité régulatrice KCNE1. Des mutations de ces deux gènes sont responsables du syndrome de Jervell et Lange-Nielsen, associant une surdité bilatérale à un allongement du QT cardiaque.